Study on the uptake and depuration kinetics of PET microfibers in the polychaete Perinereis aibuhitensis
-
摘要:
海洋微塑料污染已成为全球性环境问题,纤维是我国近海微塑料的主要存在形态。然而,微纤维对近海底栖生物的影响研究相对较少,底栖生物对微纤维的摄入和排出过程仍不明晰。本文采用近海沉积物中的代表性物种——双齿围沙蚕(Perinereis aibuhitensis)作为受试生物,以长度(1.09±0.21) mm、直径100 μm的聚对苯二甲酸乙二醇酯(PET)纤维作为目标污染物,研究海水暴露途径下沙蚕对接近环境相关浓度(50个/L、100个/L、200个/L)PET微纤维的72 h摄入过程,以及暴露结束后转移至干净海水中恢复72 h的排出动力学过程。摄入实验结果表明,对于整个72 h暴露过程而言,沙蚕对PET微纤维的摄入量总体呈上升趋势,并且在暴露结束时沙蚕的摄入量均达到最大值(分别为2.35个/g、4.89个/g和8.55个/g),各浓度组对PET微纤维的摄入速率常数Ku分别在6 h、1 h、3 h达到最大值(分别为1.70×10−4 L/kg/d、1.60×10−4 L/kg/d和1.40×10−4 L/kg/d)。排出实验结果表明,沙蚕体内PET微纤维残留量总体呈下降趋势,各处理组沙蚕体内PET微纤维残留量分别在恢复的72 h、24 h和48 h达到最小值(分别为1.17个/g、2.05个/g和2.98个/g);低浓度组沙蚕对PET微纤维的排出速率常数Kd在恢复3 h达到最大值,为(4.81±1.95)/d,对应残留半衰期t1/2为(0.28±0.18)d;中、高浓度组沙蚕的Kd在恢复1 h达到最大值,分别为(7.19±4.20)/d和(9.12±3.30)/d,对应t1/2达到最小值,分别为(0.18±0.08)d和(0.11±0.05)d。恢复阶段结束后,PET微纤维主要残留在沙蚕体内,其次是海水溶液中,粪便中最少。本研究表明,PET微纤维浓度影响沙蚕摄食和排泄微纤维的数量和速率。研究结果可为科学评估微塑料在底栖生物中的毒性效应和生态风险提供依据。
-
关键词:
- 聚对苯二甲酸乙二醇酯 /
- 微纤维 /
- 底栖生物 /
- 生物累积 /
- 速率常数
Abstract:Microplastic (MP) pollution in marine environment has become a global concern. Fiber is reported to be the main form of MPs along the coastal water of China. However, quite few studies have been conducted to explore the impact of microfibers on marine benthic organisms, and the uptake and depuration processes of microfibers by benthic organisms are still unclear. In this study, using sediment-dwelling Perinereis aibuhitensis as model organism, we investigated the uptake and depuration kinetics of polyethylene terephthalate (PET) microfibers (100 µm in diameter and 1.09±0.21 mm in length) under approaching environmentally relevant concentrations (50, 100 and 200 items/L) in P. aibuhitensis through a seawater exposure pathway. The results of uptake experiment showed that for the whole 72 h of exposure process, the ingestion of PET microfiber generally increased and reached the maximum values of 2.35 items/g, 4.89 items/g and 8.55 items/g for the low, medium and high concentration exposure groups at the end of exposure, respectively. The uptake constant Ku of PET microfibers for three concentration groups reached the maximum values of 1.70×10−4, 1.60×10−4 and 1.40×10−4 L/kg/d at 6 h, 1 h and 3 h after exposure, respectively. For the results of depuration experiment, the remaining amount of PET microfibers in P. aibuhitensis body showed a generally decreasing trend and reached the minimum value (1.17 items/g, 2.05 items/g and 2.98 items/g, respectively) in low, medium and high treatment at 72 h, 24 h and 48 h after recovery, respectively. The depuration constant Kd of PET microfibers in the low concentration group reached the maximum value (4.81±1.95)/d at 3 h after recovery and the corresponding residual half-life t1/2 is (0.28±0.18) d; for the medium and high concentration groups, Kd reached the maximum values of (7.19±4.20)/d and (9.12±3.30)/d, respectively, corresponding to t1/2 reaching the minimum value of (0.18±0.08) d and (0.11±0.05) d at 1 h after recovery, respectively. At the end of recovery stage, PET microfibers mainly remained in the worm body, followed by seawater solution, and fecal distribution being the least. This study showed that the concentration of PET microfibers affected their uptake and depuration amounts and constant rates in P. aibuhitensis. Our results provide a basis for scientific assessment of the toxic effects and ecological risks of microplastics in benthos.
-
Keywords:
- polyethylene terephthalate /
- microfiber /
- benthos /
- bioaccumulation /
- rate constant
-
塑料以其低成本和相对稳定性能,广泛应用于工业、农业和日常生活中。预计到2025年,将有1.5亿吨塑料垃圾排入海洋环境[1]。在海洋生态系统中,这些塑料垃圾在机械作用、光辐射和生物降解等过程中逐渐破碎分解成小的塑料微粒[2],其中尺寸小于5 mm的塑料微粒定义为微塑料(microplastics,MPs),被科学家称为海洋中的PM2.5[3]。Wang等[4]报道我国渤海、黄海、东海、南海海水中MPs总体污染水平最高可达33.6个/L,沉积物中MPs总体污染水平最高可达14712.0个/kg,并且海水和沉积物中MPs形态均以纤维为主,主要聚合物类型为聚丙烯(PP)、聚乙烯(PE)、聚苯乙烯(PS)和聚对苯二甲酸乙二醇酯(PET)。PET又称涤纶,主要以纤维形态存在于纺织品中,在洗涤过程中由于受到机械作用PET纤维大量脱落[5],并最终进入海洋环境。Zhang等[6]发现我国黄海和东海海域MPs中的PET纤维丰度占比高达21.6%。PET除了在海水中分布外,在沉积物中也有广泛分布。Teng等[7]发现,我国莱州湾海域沉积物中类型为PET的MPs的占比为11%。
在海洋生态系统中,底栖生物作为食物链的一个重要环节,能够混合沉积物促进基质氧化以及营养物质和污染物的再悬浮和分配,在近海生态系统的能量流动和物质循环中起重要作用。底栖生物往往对MPs不具有分辨能力,会在摄食过程中将MPs一并摄取。例如,王嘉旋等[8]对我国海州湾潮滩沉积物中沙蚕体内MPs的丰度和形态特征进行研究,发现体内检出MPs的沙蚕占比为77.78%~86.67%,MPs平均丰度为(6.68±2.21)个/g,其中纤维是最丰富的形态类别,材质以PE和PET为主。丛艺等[9]研究发现,沙蚕能够在短期暴露时间内持续摄入海水中的荧光PS微球,在转移至干净海水中恢复96 h后体内PS残留百分比只有2.2%。Wang等[10]发现,将腹足类光滑双脐螺(Biomphalaria glabrata)分别暴露在浓度为5 mg/L和0.5 mg/L的PE微粒中48 h和21 d后,其对PE微粒的48 h和21 d平均吸收速率分别为75和6.94 µg/g/h。当南极磷虾(Euphausia superba)暴露于添加20%PE的饲料中24 h后,对PE的摄入速率常数为22 ng/mg/h,排出速率常数为0.22/h。Hao等[11]对罗非鱼的研究结果表明,在21 d长期暴露条件下,罗非鱼对PS纳米塑料的摄入和排出速率常数分别为2.70~378 L/kg/d和0.138~0.407 L/kg/d。由于当前关于微纤维在海洋生物体内的摄入、排出研究较少,因此,关注微纤维在生物体内的摄入和排出动力学过程对于了解其生物有效性尤为关键,对于MPs的生态风险评估也具有重要意义。
沙蚕是底栖无脊椎动物中较为常见的海洋沉积物环境污染评价的指示生物和毒理研究的模型生物,对污染物具有较强的耐受性和指示作用。目前关于MPs在海洋生物体内的摄入、排出动力学研究主要集中在鱼类、腹足类和甲壳类[10-12],而在沙蚕等底栖多毛类体内的摄入和排出动力学研究相对匮乏。基于以上研究背景,本研究采用双齿围沙蚕(Perinereis aibuhitensis)作为受试生物,以PET微纤维作为目标污染物,初步研究了在海水暴露途径下沙蚕对PET微纤维的摄入、累积和排出动力学过程,以期为深入探讨MPs致毒机理及科学评估MPs的生态风险提供依据。
1 材料与方法
1.1 材料与试剂
PET纤维(产品编号:ES30-MT-000110,直径100 μm,长度200 m)购自上海顾特服贸易有限公司,氢氧化钾(分析纯)购自科密欧化学试剂有限公司,人工海盐购自中盐工程技术研究院有限公司,Whatman无黏合剂玻璃微纤维滤纸购自北京默迪克生物科技有限公司。
1.2 受试生物及驯养
双齿围沙蚕(P. aibuhitensis)成体购自台州沙蚕养殖基地,选取健康沙蚕用于实验室驯养。沙蚕驯养所需的沉积物采自渤海干净海域(119°41′E,38°10′N),在实验室内首先通过边晃动筛网边加人工海水(pH8.1±0.1,盐度20±1,溶解氧7.99±0.2 mg/L)的方式,使沉积物经过1 mm的筛网。取3~5 g(3个平行)筛滤后的沉积物样品进行干湿重比(dw∶ww)的测定。以0.45 μm孔径滤膜过滤的人工海水作为上层水,驯养温度为(10±2)℃,光暗比为12 h∶12 h,每3 d更换2/3上层海水。驯养期间沙蚕以沉积物中的有机物为食,及时挑出死亡的沙蚕,以免污染水质,影响其他沙蚕活力。沙蚕驯养5~7 d后用于暴露实验。
1.3 微纤维制备与表征
微纤维的制备过程简要描述如下:首先剪取一小段纤维制品,用解剖剪快速剪切,剪取的微纤维越小越好,然后用MilliQ水(18.2 Ω)冲洗粘附在解剖剪上的微纤维并收集于玻璃烧杯中。实验前将微纤维过滤至滤膜上[13]。通过扫描电子显微镜(SEM,Thermo Fisher:SU3500型)对剪取的微纤维形态和尺寸等进行表征,再对剪取的PET微纤维随机抽取200个,分批次在体视显微镜(Leica M205FA,德国)下测量尺寸范围,最后利用傅里叶变换显微红外光谱仪(μ-FITR,Nicolet iN 10 MX)鉴定聚合物组成。
1.4 摄入和排出动力学实验
PET微纤维在沙蚕体内的摄入和排出动力学实验采取海水暴露途径[9]。参考我国海水中MPs的环境浓度[4],将本实验浓度设定为50个/L(低)、100个/L(中)和200个/L(高)3个浓度组,实验浓度略高于环境浓度。依据《海洋生物水质基准推导技术指南(试行)》(HJ 1260-2022)[14]中环节动物多毛类的短期暴露实验时长要求(24~96 h),设置摄入实验的暴露时间为72 h。排出实验的暴露时长同摄入实验,并相应设置72 h的恢复时长。摄入和排出实验均设置3个平行,每个平行1只沙蚕成体。将沙蚕用滤纸吸干水分称重,随机分配到500 mL烧杯中,每个烧杯中装有250 mL已过滤的含有不同浓度PET微纤维的人工海水(水质参数条件同驯养条件)和1只沙蚕,暴露期间不喂食,暴露时间持续72 h,其间所有实验组均使用曝气石持续曝气,并覆盖保鲜膜以减少水分蒸发,暴露结束后将沙蚕取出称重并暂存于−80 ℃,后续用10%(w∶v)的KOH溶液按照10 mL/g组织湿重在60 ℃水浴消解72 h(此方法对PET微纤维的回收率为96.7%±11.5%),真空过滤后于体视显微镜下对滤膜上PET微纤维数量进行计数[15]。在排出实验中,首先将沙蚕分别于低、中、高3个浓度组中暴露72 h,暴露条件和平行设置与摄入实验一致,暴露结束后,将沙蚕全部转移至干净海水中恢复72 h。于恢复后1 h、3 h、6 h、12 h、24 h、48 h和72 h每个实验组各取3只沙蚕并暂存于−80 ℃,称重、消解,首先对沙蚕体内的PET微纤维进行计数,然后再对海水溶液中单独存在的PET微纤维和粪便包裹的PET微纤维分别计数(即体外)。
1.5 摄入和排出速率常数计算
1.5.1 排出速率常数Kd及半衰期t1/2
当沙蚕转移至干净海水中时,通过拟合一阶模型确定的排出速率常数Kd及排出半衰期t1/2分别按公式(1)和公式(2)计算:
$$ {{C}}_{{t}}={{C}}_{{0}} \cdot {{{\rm{e}}}}^{\left({-{K}}_{{{\rm{d}}}} \cdot {t}\right)} $$ (1) $$ {{t}}_{{1/2}}={{\rm{ln}}}{2}/{{K}}_{{{\rm{d}}}} $$ (2) 式中:Kd是排出速率常数(/d);t是排出时间(d);Ct和C0分别是在时间t和转入干净海水时沙蚕体内的MPs浓度(个/kg);t1/2是排出半衰期(d)。
1.5.2 残留比
沙蚕体内微纤维的残留比按照公式(3)计算:
$$ {R}={{(}{C}}_{{t}}{/}{{C}}_{{0}}{)}{\times 100\%} $$ (3) 式中:R是残留比(residual rate);Ct和C0分别是在时间t和转入干净海水时沙蚕体内的MPs浓度(个/kg)。
1.5.3 摄入速率常数Ku
吸收速率常数Ku利用非线性回归方程按照公式(4)计算:
$$ {{C}}_{{{\rm{e}}}}=\left({{K}}_{{{\rm{u}}}} \cdot \frac{{{C}}_{{{\rm{s}}}}}{{{K}}_{{{\rm{d}}}}}\right)\left[{1-}{{{\rm{e}}}}^{\left({-{K}}_{{{\rm{d}}}} \cdot {t}\right)}\right] $$ (4) 式中:Ku为吸收速率常数(L/kg/d);Cs为t时刻海水中MPs浓度(个/L);Ce是t时刻沙蚕体内MPs浓度(个/kg)。
1.6 统计分析
所有数据均以平均值±标准误差(mean±SEM)表示,使用SPSS24.0软件进行分析。利用Kolmogorov-Smirnov验证数据是否符合正态分布,方差齐性分析采用Levene检验。采用比较均值的单因素方差分析方法(One-way ANOVA test)进行统计学分析,P<0.05考虑为差异显著。
2 结果与讨论
2.1 PET微纤维的表征
SEM结果表明,PET微纤维呈圆柱形,颜色透明(图1a)。通过傅立叶变换显微红外光谱仪对PET微纤维进行鉴定(图1b),匹配度达96.86%,证实聚合物类型为PET。用于实验的PET微纤维尺寸范围为(1.09±0.21)mm(图1c)。
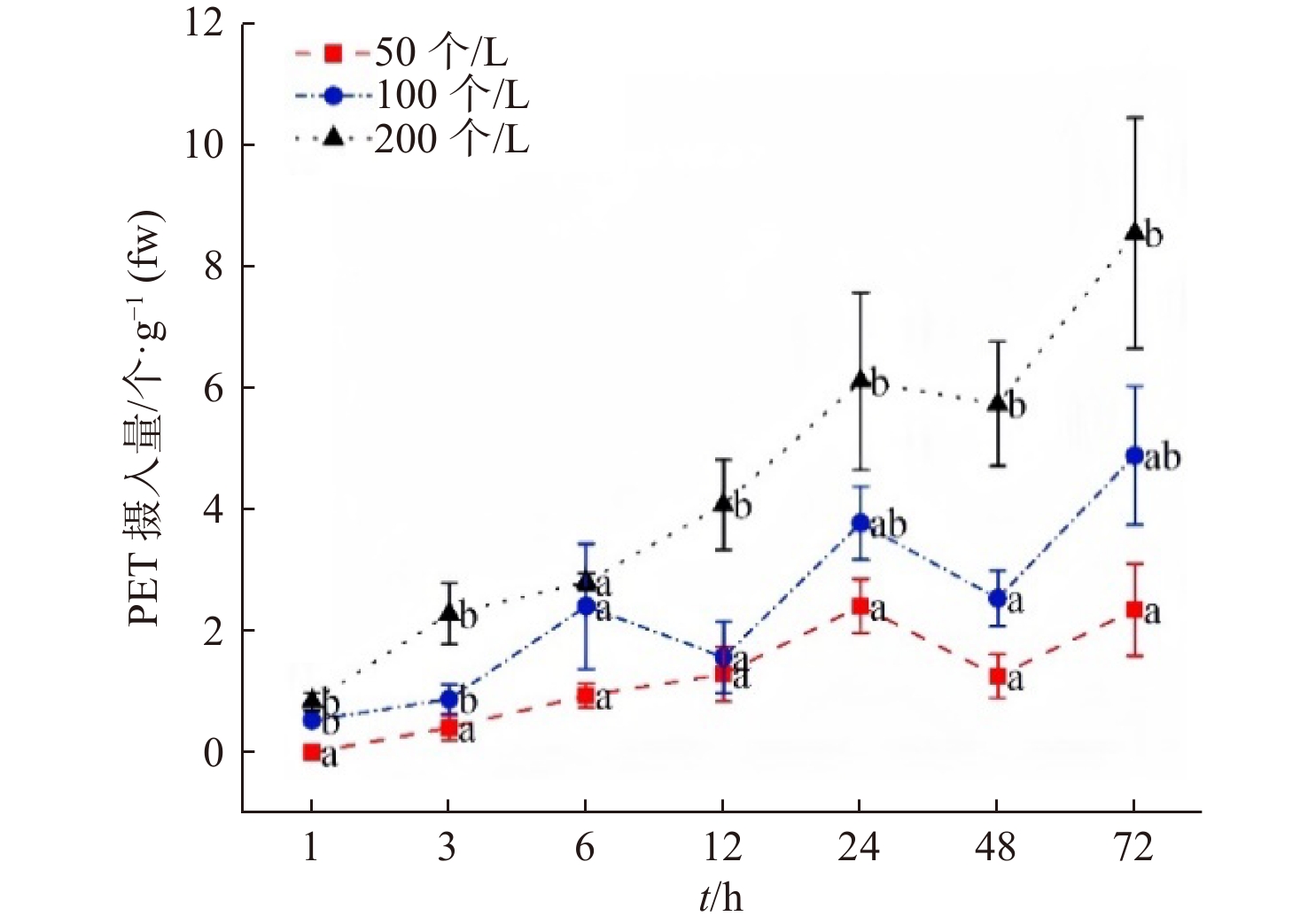
2.2 沙蚕对PET微纤维的摄入
随着暴露时间延长,沙蚕体内的PET微纤维摄入量总体呈上升趋势(图2)。在暴露1 h时,中、高浓度组(0.53个/g、0.84个/g)沙蚕的PET微纤维摄入量与低浓度(0个/g)存在显著性差异(P<0.05);在暴露3 h时,中、高浓度组沙蚕的PET微纤维摄入量(0.88个/g、2.28个/g)分别是低浓度组沙蚕(0.41个/g)的2.1倍和5.6倍,与低浓度组存在显著性差异(P<0.05);在暴露6 h时,低、中、高浓度组沙蚕的PET微纤维摄入量分别为0.94个/g、2.41个/g、2.81个/g,各浓度组无显著性差异;在暴露12 h时,高浓度组沙蚕的PET微纤维摄入量(4.08个/g)分别是低、中浓度组沙蚕(1.29个/g、1.57个/g)的3.2倍和2.6倍,存在显著性差异(P<0.05);在暴露24 h时,高浓度组沙蚕的PET微纤维摄入量(6.11个/g)是低浓度组沙蚕(2.41个/g)的2.5倍,与低浓度组存在显著性差异(P<0.05);在暴露48 h时,高浓度组沙蚕的PET微纤维摄入量(5.74个/g)分别是低、中浓度组沙蚕(1.26个/g、2.54个/g)的4.6倍和2.3倍,存在显著性差异(P<0.05);在暴露结束时(72 h),各浓度组沙蚕体内PET微纤维摄入量均达到最大值,并且高浓度组沙蚕的PET微纤维摄入量(8.55个/g)是低浓度组沙蚕(2.35个/g)的3.6倍,存在显著性差异(P<0.05)。本实验结果表明,沙蚕在72 h暴露期间内摄入PET微纤维的数量持续增加,因此摄入量有可能还没达到峰值,后续也会考虑进一步延长暴露时间来探究沙蚕对PET微纤维的摄入量达到峰值的时刻。
MPs进入复杂海洋环境中后,容易吸附一些黏土颗粒、有机碎片、海藻、微生物等,这些过程会增大MPs颗粒的密度或改变其表面特性,促使其发生沉降,这就大大增加了活跃在水−沉积物界面的底栖生物对其摄入的概率[16]。已有实验结果显示,牡蛎和沙蠋(Arenicola marina)等底栖动物能够非选择性地摄入MPs[17-18]。对海州湾沙蚕摄入体内的MPs尺寸的调查结果表明,沙蚕能够摄入粒径范围为0.12~4.59 mm的MPs,其中<1 mm的MPs占比达到55.29%,超过93.95%的MPs的粒径<2.5 mm[8]。Wright等[17]研究表明,长期(10 d)暴露于含有5%(按重量计)未添加塑化剂聚氯乙烯(UPVC)的沉积物中的沙蠋与对照组和暴露于1% UPVC相比,其摄食活性显著降低,表明随着暴露时间延长,高浓度组沙蠋摄入MPs总量很可能随着摄食活动的降低而减少。由此可见,与本研究的短期暴露(72 h)相比,长期慢性暴露可能会造成MPs在肠道的停留时间延长,从而减缓了对MPs的摄入。丛艺等[9]研究结果表明,沙蚕在暴露于含有直径为10 μm PS微粒的海水中48 h内可持续摄入PS微球,在暴露结束后MPs摄入量达到最大值,约为163个/g。Besseling等[19]研究结果发现,沙蠋暴露于含有0~7.4% PS微球(干重)的沉积物后,PS微球浓度越高,沙蠋摄食的PS微球越多,这与本研究中MPs浓度对沙蚕的PET微纤维摄入量影响的变化趋势一致。因此,上述MPs在不同种类底栖生物体内的研究结果与本研究结果的摄入量差异应主要归因于MPs种类、暴露时间和暴露途径等。除了上述因素外,本实验结果表明,微塑料浓度也是摄入的重要影响因素,底栖生物沙蚕摄入PET微纤维的量与其暴露浓度呈正相关关系(浓度依赖性)。
众多研究表明,不同受试生物由于暴露条件(介质、浓度、时间等)不同,对MPs的摄入速率常数在数量级上存在较大差异。本研究采用PET微纤维浓度,沙蚕在此浓度条件下对微纤维的摄入情况更能体现环境相关性。表1列出了不同浓度处理组沙蚕对PET微纤维的摄入速率常数、残留半衰期和排出速率常数。结果表明,低浓度组的摄入速率常数Ku仅在暴露1 h时与中、高浓度组存在显著性差异,此外,低、中、高浓度组的Ku分别在暴露6 h、1 h、3 h达到最大值(分别为1.70×10−4 L/kg/d、1.60×10−4 L/kg/d和1.40×10−4 L/kg/d),之后随着暴露时间延长,Ku逐渐减小,在暴露48 h时各处理组的Ku均达到最小(分别为2.60×10−5 L/kg/d、2.60×10−5 L/kg/d和2.80×10−5 L/kg/d)。上述结果表明,不同浓度组的沙蚕对PET微纤维的摄入速率存在差异,低浓度组沙蚕摄入速率呈现先升高后降低的趋势,中浓度组沙蚕摄入速率在暴露前6 h较快,随后逐渐下降,而高浓度组沙蚕摄入速率在暴露前3 h较快,随后逐渐下降。已有研究结果表明,斑马鱼在暴露于不同浓度(5 mg/L、10 mg/L、15 mg/L)PS纳米塑料50 d后,肠道、肝脏、鳃、肌肉和大脑对PS纳米塑料的摄入速率常数变化范围分别为0.025~0.098(5 mg/L)、0.029~0.095(10 mg/L)和0.027~0.096 L/kg/d(15 mg/L)[20];罗非鱼暴露于海水中不同粒径(108 nm和203 nm)PS纳米塑料21 d后,对其摄入速率常数分别为8.62~378 L/kg/d和2.70~60.7 L/kg/d[11]。以上结果表明,毒代动力学常数除了与MPs浓度有关以外,与MPs尺寸也存在一定联系。由于MPs对沙蚕的毒代动力学研究几近空白,所以,本研究结果对于科学评估MPs在底栖生物中的毒性效应和生态风险具有重要意义。
表 1 沙蚕对PET微纤维的摄入速率常数(Ku)、排出速率常数(Kd)和残留半衰期(t1/2)Tab. 1 The uptake rate constant (Ku), depuration rate constant (Kd), and residual half-life (t1/2) of PET microfibers by P. aibuhitensist Ku/×10−5 L·kg−1·d−1 Kd/d−1 t1/2/d 50个/L 100个/L 200个/L 50个/L 100个/L 200个/L 50个/L 100个/L 200个/L 1 h 0a 16.00±2.99b 13.00±2.98b 4.63±2.75 7.19±4.20 9.12±3.30 0.59±0.46 0.18±0.08 0.11±0.05 3 h 10.00±5.06 9.04±2.25 14.00±3.59 4.81±1.95 3.11±2.35 4.36±0.69 0.28±0.18 0.80±0.47 0.17±0.03 6 h 17.00±4.03 14.00±5.75 7.20±0.50 3.27±0.22a 1.22±0.15b 1.51±0.52b 0.21±0.02a 0.59±0.07a 2.66±0.95b 12 h 12.00±3.80 5.00±2.16 7.80±1.24 1.43±0.32 0.72±0.14 1.51±0.36 0.53±0.10 1.05±0.25 0.54±0.17 24 h 11.00±2.11 9.30±2.18 6.50±1.35 0.86±0.16 0.76±0.21 0.80±0.15 4.87±2.55 1.16±0.44 0.92±0.15 48 h 2.60±0.75 2.60±0.45 2.80±0.26 0.32±0.06 0.30±0.05 0.49±0.07 2.30±0.40 2.40±0.39 1.48±0.27 72 h 5.00±1.35 4.40±1.62 3.60±1.07 0.32±0.04 0.23±0.01 0.29±0.06 2.26±0.33 3.14±0.22 2.63±0.51 2.3 沙蚕对PET微纤维的排出
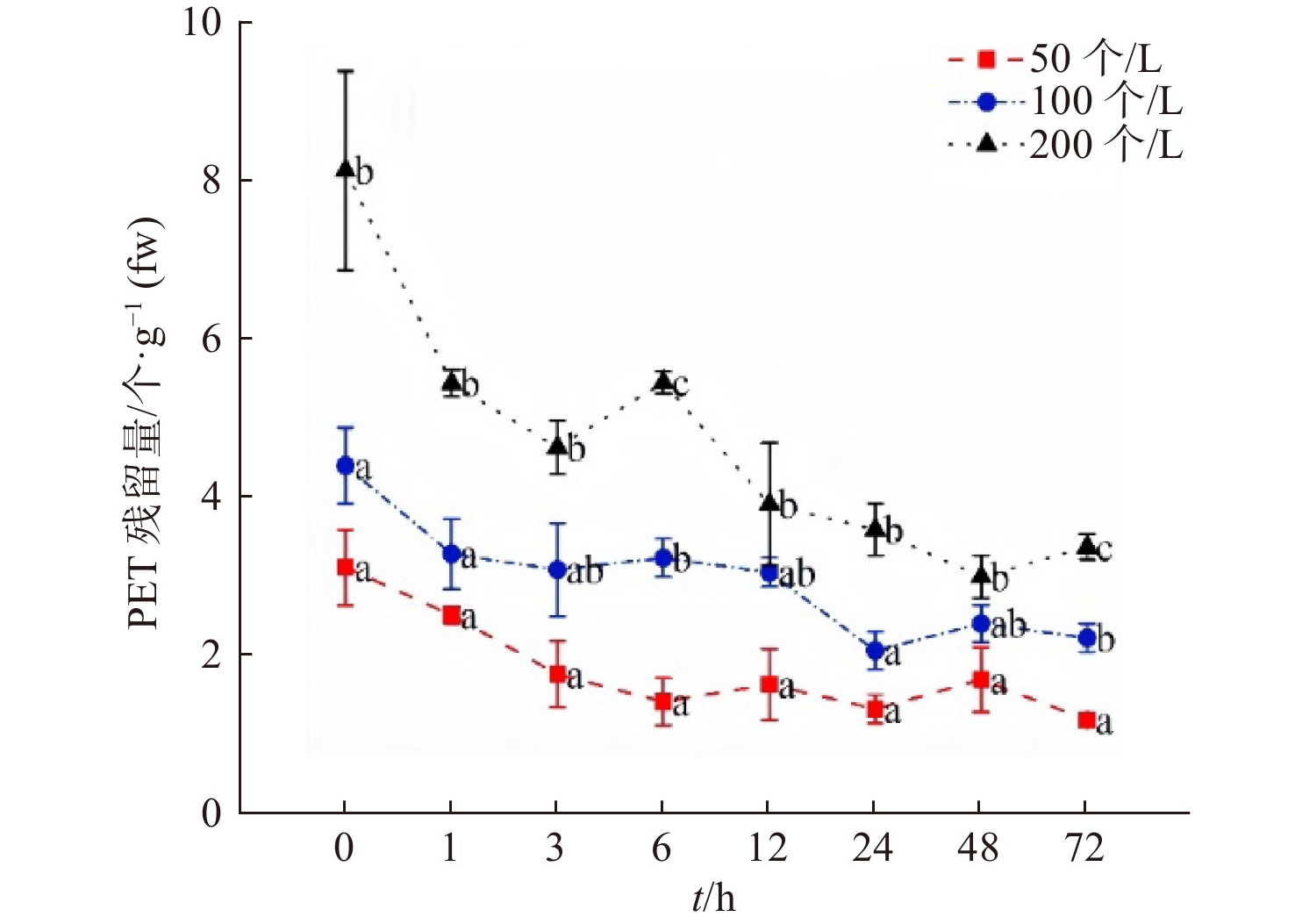
2.3.1 沙蚕体内PET微纤维残留量
在排出实验中,沙蚕于含有PET微纤维的海水中暴露72 h后转移至干净海水中恢复72 h(图3)。结果表明,随着时间延长,沙蚕体内PET微纤维残留量总体呈下降趋势,低、中浓度组和高浓度组分别在暴露72 h、24 h和48 h达到最小值(分别为1.17个/g、2.05个/g和2.98个/g);高浓度组在恢复期1 h内即快速排出体内残留的PET微纤维;而低、中浓度组的沙蚕在整个72 h恢复过程中排出PET微纤维的趋势较为平缓。研究发现[9],沙蚕对摄入体内的PS微粒具有一定的回避或排斥作用,这种快速排出机制可减少大部分MPs在肠道的停留时间,有利于沙蚕保护自身免受或减轻MPs的有害影响。本实验结果表明,低、中、高浓度组沙蚕在恢复48 h、48 h 和72 h时体内PET微纤维残留率分别为51.32%、60.97%和53.03%,表明沙蚕对PET微纤维也存在一种快速排出机制,这与上述研究一致。统计学分析结果显示,在整个72 h恢复过程中,低浓度组与中浓度组沙蚕体内PET残留量只在恢复6 h和72 h时存在显著性差异,与高浓度组沙蚕体内PET残留量在所有时间点均存在显著性差异,而中浓度组与高浓度组沙蚕体内PET残留量只在恢复1 h、6 h、24 h和72 h存在显著性差异,表明PET微纤维暴露浓度的高低对沙蚕排泄MPs数量的能力存在不同影响。
由表1可知,低浓度组沙蚕的排出速率常数和半衰期仅在恢复6 h时与中、高浓度组存在显著性差异。低浓度组的Kd在3 h达到最大值,为(4.81±1.95)/d,对应残留半衰期t1/2较小,为(0.28±0.18)d;中、高浓度组均在恢复1 h达到最大值,分别为(7.19±4.20)/d和(9.12±3.30)/d,对应t1/2也达到最小值,分别为(0.18±0.08) d和(0.11±0.05)d。当沙蚕快速排出体内高浓度的MPs后,随着时间的延长,Kd逐渐减小,t1/2逐渐增大,在恢复72 h时各处理组的Kd均达到最小,分别为(0.32±0.04)/d、(0.23±0.01)/d和(0.29±0.06)/d,对应t1/2达到最大,分别为(2.26±0.33)d、(3.14±0.22)d和(2.63±0.51) d。已有研究表明,罗非鱼暴露于海水中不同粒径(108 nm和203 nm)PS纳米塑料21 d后,排出速率常数分别为0.246~0.407/d和0.138~0.299/d[11],与本研究中沙蚕恢复48 h、72 h的排出速率常数较为接近,而斑马鱼在暴露于不同浓度(5 mg/L、10 mg/L、15 mg/L)PS纳米塑料50 d后,排出速率常数分别为0.051~0.32/d、0.081~0.37/d和0.055~0.35/d[20],其中在肠道(0.32~0.37/d)、肝脏(0.29~0.32/d)和鳃(0.27~0.31/d)中的排出速率常数与本研究恢复48 h、72 h的排出速率常数较为接近。
2.3.2 沙蚕粪便中的PET微纤维
在排出实验中,在沙蚕粪便中也观察到了PET微纤维的存在。如图4所示,恢复12 h内各浓度组的粪便中PET微纤维个数几乎为0,恢复12 h后,各暴露组粪便中PET微纤维数量均开始上升,于恢复48 h均达到最大值(分别为2.00个、2.67个和4.00个),在恢复72 h时,高浓度组沙蚕粪便中的PET微纤维个数仍为4个,而低、中浓度组粪便中PET微纤维数量均显著下降至0.67个,分别占各处理组PET微纤维排出总量的57.26%、57.26%和33.33%。统计学分析结果表明,在恢复12 h内,各处理组粪便中PET微纤维个数均无显著性差异,在恢复24 h、48 h和72 h时,低浓度组与中浓度组粪便中PET微纤维个数无显著性差异(P>0.05),而与高浓度组存在显著性差异(P<0.05),中浓度组与高浓度组粪便中PET微纤维个数也存在显著性差异(P<0.05)。粪便是海洋生物将摄入体内的MPs排出体外的一种重要载体。日本虎斑猛水蚤(Tigriopus japonicus)暴露于10 μm荧光PS微粒48 h后,也在排出的粪便颗粒中发现了PS微粒的存在[21]。Wang等[10]将腹足类动物——光滑双脐螺暴露在浓度为5 mg/L的PE微粒24 h后,有(2.9±1.2) mg的微珠通过粪便排出,占该处理组中微珠排出总数的28.7%±12.7%。以上摄入、排出的研究大多集中在微球形态,对于纤维形态研究较少,本研究选取纤维作为目标污染物,对于现实海洋环境中MPs的生态风险评估具有重要意义。
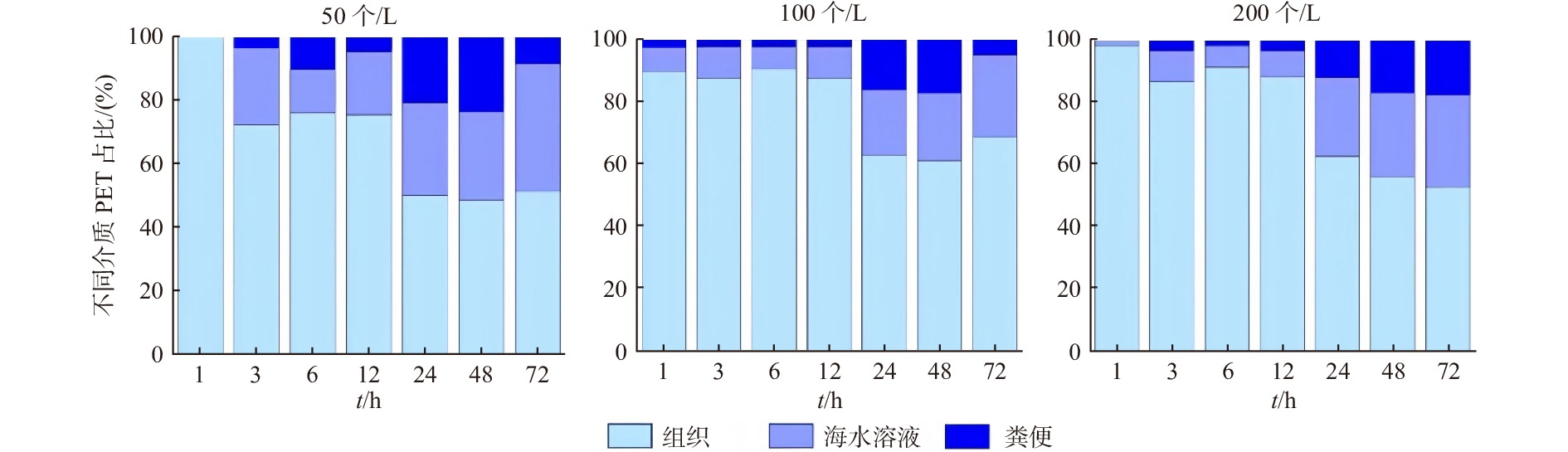
2.4 PET微纤维在不同介质中的占比
比较PET微纤维在不同介质中的占比情况(图5),可以看出,不同处理组在不同介质的占比均为组织>海水溶液>粪便。Wang等[10]研究结果表明,当腹足类动物——光滑双脐螺暴露在海水PE微珠48 h后,MPs在各个介质占比情况为粪便>组织>海水溶液,与本研究结果的差异表明,暴露时间、MPs种类、受试物种等均会影响MPs在不同介质中的占比情况。有研究表明,北大西洋的多种浮游动物能够摄入粒径为1.7~30.6 μm的PS微粒,并通过“假粪”将PS微粒排出体外[22];Wegner等研究表明,底栖生物也能产生“假粪”,即将摄入体内的MPs直接排出体外,当贻贝(Mytilus edulis)暴露在含有不同浓度(0、0.1 g/L、0.2 g/L和0.3 g/L)PS微粒的海水中(30 nm)8 h后,在所有处理组中均观察到粪便尤其是“假粪”的存在[23]。在本研究中,在恢复72 h时,相比于中、高浓度处理组(体外占比分别为31%和47%),低浓度处理组的PET微纤维在粪便和海水溶液(即体外)中的占比更高(体外占比为48.7%),表明低浓度组沙蚕倾向于将PET微纤维排出体外,除了少数以粪便(8.5%)形式排出外,大部分PET微纤维是以上述表述中“假粪”(48.2%)的形式直接将MPs排到海水溶液中,但这种形式需要消耗额外能量,会造成能量的损耗[23]。相比于低浓度处理组(体内占比为49%),中、高浓度处理组PET微纤维在生物组织(即体内)中的占比较高(占比分别为69%和53%),表明当MPs浓度升高时生物体不易于将其排出体外。Wright等[17]通过一个概念模型得出结论:高浓度的MPs会导致沙镯摄食活性抑制、肠道停留时间延长,从而很可能导致底栖生物排出MPs的速率减缓。这与本实验观察到的高浓度暴露组沙蚕的排出速率常数逐渐降低,以及中、高浓度暴露组沙蚕体内的PET微纤维残留百分比较高的结果一致。关于MPs摄入后在生物体的排出情况,现有研究多局限于分析MPs的体内残留量和粪便中的排出量,通过MPs在各个介质中占比情况分析MPs的排出方式、残留/排出倾向的研究相对较少。本研究统计了恢复阶段结束后不同暴露浓度下PET微纤维在体内和体外环境介质中的占比情况,结果表明,中、高浓度PET微纤维暴露很可能增加其随食物链传递的风险,对于基于MPs浓度评估其在海洋环境中的生态风险具有重要意义。
3 结 论
(1)在摄入实验中,沙蚕能够摄入PET微纤维,且体内PET微纤维累积量与暴露浓度呈正相关关系;对于沙蚕对PET微纤维的摄入速率常数,低浓度暴露组呈现先升高后降低的趋势,中、高浓度暴露组总体呈下降趋势。
(2)在排出实验中,沙蚕体内PET残留量与暴露浓度呈正相关关系;对于沙蚕对PET微纤维的排出速率常数,各浓度组随时间均呈现降低趋势;对于半衰期,各浓度组间无显著差异。恢复阶段PET微纤维在各介质中的占比顺序为组织>海水溶液>粪便。与低浓度暴露组相比,中、高浓度暴露组沙蚕体内的PET微纤维更不易排出体外(体内>体外),表明中、高浓度PET微纤维暴露时沙蚕体内PET微纤维随食物链传递的可能性更高,进而增加MPs在海洋环境中的生态风险。
-
表 1 沙蚕对PET微纤维的摄入速率常数(Ku)、排出速率常数(Kd)和残留半衰期(t1/2)
Tab. 1 The uptake rate constant (Ku), depuration rate constant (Kd), and residual half-life (t1/2) of PET microfibers by P. aibuhitensis
t Ku/×10−5 L·kg−1·d−1 Kd/d−1 t1/2/d 50个/L 100个/L 200个/L 50个/L 100个/L 200个/L 50个/L 100个/L 200个/L 1 h 0a 16.00±2.99b 13.00±2.98b 4.63±2.75 7.19±4.20 9.12±3.30 0.59±0.46 0.18±0.08 0.11±0.05 3 h 10.00±5.06 9.04±2.25 14.00±3.59 4.81±1.95 3.11±2.35 4.36±0.69 0.28±0.18 0.80±0.47 0.17±0.03 6 h 17.00±4.03 14.00±5.75 7.20±0.50 3.27±0.22a 1.22±0.15b 1.51±0.52b 0.21±0.02a 0.59±0.07a 2.66±0.95b 12 h 12.00±3.80 5.00±2.16 7.80±1.24 1.43±0.32 0.72±0.14 1.51±0.36 0.53±0.10 1.05±0.25 0.54±0.17 24 h 11.00±2.11 9.30±2.18 6.50±1.35 0.86±0.16 0.76±0.21 0.80±0.15 4.87±2.55 1.16±0.44 0.92±0.15 48 h 2.60±0.75 2.60±0.45 2.80±0.26 0.32±0.06 0.30±0.05 0.49±0.07 2.30±0.40 2.40±0.39 1.48±0.27 72 h 5.00±1.35 4.40±1.62 3.60±1.07 0.32±0.04 0.23±0.01 0.29±0.06 2.26±0.33 3.14±0.22 2.63±0.51 -
[1] JAMBECK J R, GEYER R, WILCOX C, et al. Plastic waste inputs from land into the ocean[J]. Science, 2015, 347(6223): 768-771. doi: 10.1126/science.1260352
[2] DA COSTA J P, SANTOS P S M, DUARTE A C, et al. (Nano)plastics in the environment - Sources, fates and effects[J]. Science of the Total Environment, 2016, 566-567: 15-26. doi: 10.1016/j.scitotenv.2016.05.041
[3] PENG G Y, ZHU B S, YANG D Q, et al. Microplastics in sediments of the Changjiang Estuary, China[J]. Environmental Pollution, 2017, 225: 283-290. doi: 10.1016/j.envpol.2016.12.064
[4] WANG Q, GUAN C Y, HAN J, et al. Microplastics in China Sea: Analysis, status, source, and fate[J]. Science of the Total Environment, 2022, 803: 149887. doi: 10.1016/j.scitotenv.2021.149887
[5] MAC NAMARA C, GABRIELE A, AMADOR C, et al. Dynamics of textile motion in a front-loading domestic washing machine[J]. Chemical Engineering Science, 2012, 75: 14-27. doi: 10.1016/j.ces.2012.03.009
[6] ZHANG C F, ZHOU H H, CUI Y Z, et al. Microplastics in offshore sediment in the Yellow Sea and East China Sea, China[J]. Environmental Pollution, 2019, 244: 827-833. doi: 10.1016/j.envpol.2018.10.102
[7] TENG J, ZHAO J M, ZHANG C, et al. A systems analysis of microplastic pollution in Laizhou Bay, China[J]. Science of the Total Environment, 2020, 745: 140815.
[8] 王嘉旋, 宋可心, 孙一鑫, 等. 海州湾潮间带沙蚕对沉积物微塑料的指示作用[J]. 环境科学, 2021, 42(9): 4341-4349. [9] 丛 艺, 周建行, 孙粒钧, 等. 荧光聚苯乙烯微粒在沙蚕体内的摄入、排出及其毒性效应[J]. 海洋环境科学, 2019, 38(2): 161-166. doi: 10.12111/j.mes20190201 [10] WANG Y, BAYNES A, RENNER K O, et al. Uptake, Elimination and Effects of Cosmetic Microbeads on the Freshwater Gastropod Biomphalaria glabrata[J]. Toxics, 2022, 10(2): 87. doi: 10.3390/toxics10020087
[11] HAO T W, GAO Y, LI Z C, et al. Size-Dependent Uptake and Depuration of Nanoplastics in Tilapia (Oreochromis niloticus) and Distinct Intestinal Impacts[J]. Environmental Science & Technology, 2023, 57(7): 2804-2812.
[12] XIA B, ZHANG J, ZHAO X, et al. Polystyrene microplastics increase uptake, elimination and cytotoxicity of decabromodiphenyl ether (BDE-209) in the marine scallop Chlamys farreri[J]. Environmental Pollution, 2020, 258: 113657. doi: 10.1016/j.envpol.2019.113657
[13] 李陵云. 微塑料的制备及其在暴露实验中的应用[D]. 上海: 华东师范大学, 2011: 43. [14] HJ 1260-2022. 海洋生物水质基准推导技术指南(试行)[S]. [15] ROCHMAN C M, TAHIR A, WILLIAMS S L, et al. Anthropogenic debris in seafood: Plastic debris and fibers from textiles in fish and bivalves sold for human consumption[J]. Scientific Reports, 2015, 5: 14340. doi: 10.1038/srep14340
[16] WOODALL L C, SANCHEZ-VIDAL A, CANALS M, et al. The deep sea is a major sink for microplastic debris[J]. Royal Society Open Science, 2014, 1(4): 140317. doi: 10.1098/rsos.140317
[17] WRIGHT S L, ROWE D, THOMPSON R C, et al. Microplastic ingestion decreases energy reserves in marine worms[J]. Current Biology, 2013, 23(23): R1031-1033. doi: 10.1016/j.cub.2013.10.068
[18] SUSSARELLU R, SUQUET M, THOMAS Y, et al. Oyster reproduction is affected by exposure to polystyrene microplastics[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9): 2430-2435.
[19] BESSELING E, WEGNER A, FOEKEMA E M, et al. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L. )[J]. Environmental Science & Technology, 2013, 47(1): 593-600.
[20] HABUMUGISHA T, ZHANG Z X, FANG C, et al. Uptake, bioaccumulation, biodistribution and depuration of polystyrene nanoplastics in zebrafish (Danio rerio)[J]. Science of the Total Environment, 2023, 893: 164840. doi: 10.1016/j.scitotenv.2023.164840
[21] 刘全斌, 张明兴, 丁光辉, 等. 微塑料在日本虎斑猛水蚤(Tigriopus japonicus)体内的摄入、排出及对其摄食行为的影响[J]. 生态毒理学报, 2020, 15(4): 184-191. doi: 10.7524/AJE.1673-5897.20191216002 [22] COLE M, LINDEQUE P, FILEMAN E, et al. Microplastic ingestion by zooplankton[J]. Environmental Science & Technology, 2013, 47(12): 6646-6655.
[23] WEGNER A, BESSELING E, FOEKEMA E M, et al. Effects of nanopolystyrene on the feeding behavior of the blue mussel (Mytilus edulis L.)[J]. Environmental Toxicology and Chemistry, 2012, 31(11): 2490-2497. doi: 10.1002/etc.1984
-
期刊类型引用(1)
1. 符清露,董志远,李宝泉,陈莉,孙德斌,倪艳梅,唐永政,陈琳琳. 基于环境DNA宏条形码技术的黄河三角洲典型潮沟单元秋季无脊椎动物多样性及共现网络分析. 海洋学报. 2024(11): 75-90 .  百度学术
百度学术
其他类型引用(0)



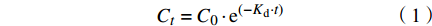
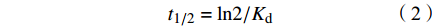
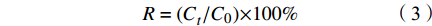
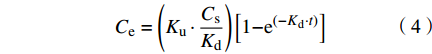
 下载:
下载: