Effects of environmental concentrations of trimethoprim on the growth and biochemical components of marine microalgae
-
摘要:
为了解环境浓度甲氧苄啶(trimethoprim,TMP)对海洋微藻的毒性效应,本文探究了TMP对中肋骨条藻(Skeletonema costatum)和三角褐指藻(Phaeodactylum tricornutum)生长及其生化组分的影响。结果表明,TMP对三角褐指藻的生长具有一定的促进作用,尤其是TMP为150 ng/L时,对其促进效果最为显著,藻细胞密度的最大增幅达到65%。TMP对中肋骨条藻生长的影响呈现“毒物兴奋效应(hormesis)”。在暴露前期,TMP会显著促进三角褐指藻光合色素的合成;但随着暴露时间的延长,TMP可显著抑制其光合色素合成。此外,TMP对三角褐指藻总蛋白的合成也有一定的促进作用。暴露前期,TMP对三角褐指藻的总脂合成有一定的促进作用;随着暴露时间的延长,总碳水化合物和总脂含量的变化均呈现先抑制后促进趋势。总体而言,与三角褐指藻相比,中肋骨条藻对TMP更加敏感。
Abstract:To understand the toxic effects of environmental concentrations of trimethoprim (TMP) on marine microalgae, the effects of TMP on the growth and bioactive components of Skeletonema costatum and Phaeodactylum tricornutum were explored. The findings revealed that TMP had a stimulating effect on the growth of P. tricornutum, among which the 150 ng/L TMP treatment group had the most significant promotion effect, resulting in a maximum 65% increase in cell density. When TMP concentration was below, it promoted the growth of S. costatum to a certain extent; however, as concentration increased, an inhibitory effect was observed (i.e., hormesis). TMP could significantly promoted the synthesis of photosynthetic pigments in P. tricornutum during the early exposure stages, but as exposure time extended, it significantly inhibited pigment synthesis. Furthermore, TMP partially stimulated the synthesis of total protein in P. tricornutum and promoted total lipid synthesis in P. tricornutum at the early stage of exposure. The total carbohydrate and total lipid levels had a similar trend over time, initially being inhibited and subsequently enhanced. Overall, S. costatum displayed greater sensitivity to TMP compared to P. tricornutum.
-
随着人口的急剧增长和人类对动物蛋白食物需求的不断增加,抗生素的使用量越来越大。在我国黄海、渤海和东海海域内,磺胺类、氟喹诺酮类、四环素类和大环内酯类抗生素均有不同程度的检出,且各类抗生素检出浓度介于ng/L到μg/L之间[1-3]。造成水体抗生素污染的人为因素主要是畜禽养殖和水产养殖废水排放[4]。据报道,2018年兽用抗菌药物全球使用总量为69455 t,其中水产用量达123.32 mg/kg[5],且大部分磺胺类药物性质稳定、生物降解性差,可在水和土壤环境中不断蓄积,并随地表径流汇入海洋。此外,甲氧苄啶(trimethoprim,TMP)作为一种磺胺类药物的抗菌增效剂,能够干扰细菌的叶酸代谢,阻止细菌核酸和蛋白质合成,且与磺胺类、氟喹诺酮类和氨基糖苷类等抗生素联用具有较强的协同作用,其抗菌效果可增强数倍,被广泛应用于水产养殖中,最终导致TMP在我国近岸海域被频繁检出。其中,位于黄海海域水产养殖区中的TMP检出率高达100%[1]。磺胺甲噁唑、TMP和恩诺沙星的检出率均在90%以上,其最大检出浓度分别为30.0 ng/L、7.1 ng/L和2364.8 ng/L[6]。值得注意的是,渤海莱州湾内TMP最大检出浓度高达398.94 ng/L[7]。由此可见,TMP可在海洋环境中不断蓄积,而海水中抗生素的长期残留致使细菌耐药性上升,会对水环境及水生生物造成不利影响,最终危害整个水生环境乃至人类健康。
目前,国内外已有部分研究报道了TMP对水生生物的毒性作用。TMP对水生生物的LC50或EC50值范围为0.874~253 mg/L[8]。需要注意的是,涉及TMP对海洋生物影响的研究较少。前期研究发现,中肋骨条藻(Skeletonema costatum)和三角褐指藻(Phaeodactylum tricornutum)对TMP较为敏感,其96 h EC50值分别为2.748 mg/L和0.874 mg/L[8]。此外,关于TMP对水生生物的影响,多数研究通过LC50或EC50评价其毒性,其浓度值远远高于海洋环境中TMP实际浓度。因此,有必要开展环境相关浓度TMP对海洋生物的影响研究。为探究环境浓度下TMP对海洋微藻生长的影响,本研究以中肋骨条藻和三角褐指藻为研究对象,通过测定2种微藻的藻细胞密度、光合色素和生物活性物质的含量,分析TMP对微藻光合作用和生物活性物质合成的影响。本研究的结果可为TMP在海洋环境中的潜在生态风险评价提供理论依据。
1 材料与方法
1.1 材 料
试剂:TMP(纯度≥98%)购自中国(上海)梯希爱化成工业发展有限公司。用于配制ESAW(enriched seawater,artificial water)培养基[9]和测定微藻生化组成所用化学试剂均为国产分析纯或生化试剂。
微藻:中肋骨条藻和三角褐指藻均由中国海洋大学微藻种质库提供。
1.2 微藻驯养
将培养至指数生长期的微藻接种于含100 mL ESAW培养基(pH为7.98,盐度为31.0)的250 mL锥形瓶中,置于20 ℃、光强60 μmol/(m2·s)、光暗周期14 h∶10 h的条件下驯养2周。驯养过程中,每3~4 d将微藻培养液接种至新鲜培养基中。
1.3 微藻生长实验
将培养至指数生长期的微藻接种于含250 mL培养基的500 mL锥形瓶中,中肋骨条藻和三角褐指藻的初始接种密度分别为1×104 cells/mL和5×104 cells/mL。用移液枪或微量进样器加入一定体积TMP储备液,使微藻分别暴露于不同浓度TMP中。表1汇总了国内外海域中TMP的浓度范围。据此,本研究将TMP浓度设置为5 ng/L、25 ng/L、50 ng/L、100 ng/L、150 ng/L、200 ng/L、250 ng/L和500 ng/L,同时将不添加TMP的处理组作为对照组。对照组和处理组均设3个平行。将微藻置于20 ℃、光强60 μmol/(m2·s)、光暗周期14 h∶10 h的条件下培养至平台期(10 d),培养期间不更换培养基,每天定时摇藻2次,并随机更换锥形瓶位置。每24 h在光学显微镜下用血球计数板测定一次藻细胞密度(×104 cells/mL)。
表 1 国内外海域中TMP的污染现状Tab. 1 The pollution status of TMP in different sea areas国家 海域 浓度/ng·L−1 检出率/(%) 参考文献 中国 黄渤海 0.09~45.67 100 [4] 黄东海 0.269~2.88 100 [10] 莱州湾 1.3~330 100 [11] 莱州湾 5.02~398.94 100 [7] 辽东湾 1.4~18.2 100 [12] 渤海湾 ND~120 [13] 维多利亚海湾 ND~216 50 [14] 斐济 南太平洋维提岛南部 0.13~230 71 [15] 韩国 黄渤海 <0.04~1.18 100 [4] 南海 ND~5.30 83 [16] 俄罗斯 芬兰湾东部 ND~0.6 6 [17] 沙特阿拉伯 红海 ND~45.6 77 [18] 比利时 大西洋东部北海海湾 ND~29 [19] 希腊 东地中海 <0.4~3.4 100 [20] 波兰 波罗的海南部 ND~14.2 [21] 波罗的海南部 <MDL~279 100 [22] 注:ND表示未检出;MDL表示检出限 1.4 光合色素含量的测定
从各处理组3个平行样中分别取5 mL藻液,经0.45 μm玻璃纤维滤膜抽滤后将滤膜置于10 mL离心管中,加入5 mL 90%丙酮,摇匀。在黑暗处抽提24 h后,以5000 r/min的转速离心15 min。取上清液,使用可见分光光度计分别于630 nm和664 nm波长处测定抽提液吸光度值(A),根据以下公式[23]计算硅藻叶绿素a(Chl a)和叶绿素c(Chl c)含量,最终结果以μg/(106 cells)表示。
$$ {{\mathrm{Chl}}}{a}={11.47}{{A}}_{{664}}-{0.40}{{A}}_{{630}}{/}{D}$$ (1) $$ {{\mathrm{Chl}}}{c}={24.36}{{A}}_{{630}}-{3.73}{{A}}_{{664}}{/}{D} $$ (2) 式中:D为藻细胞密度。
1.5 生化组分的测定
将2种微藻培养至平台期(10 d),每2 d从处理组的3个平行样中分别取适量藻液在4 ℃下以10000 r/min离心20 min,收集藻细胞,用预冷的0.2 mol/L HClO4抽提2次,离心后移去上清液。在HClO4抽提后的藻团中用氯仿−甲醇溶液(1∶1,V/V)抽提2次后离心,上清液用于总脂的测定,无脂藻团用于总蛋白的测定。总蛋白含量选用考马斯亮蓝法采用蛋白试剂盒(南京建成生物工程研究所)进行测定。将1 mL 1 mol/L NaOH加入酸抽提的无脂藻团中,在沸水中水浴10 min直至充分溶解,溶液用于总蛋白含量的测定,单位为mg/(106 cells)。总脂采用重铬酸盐氧化法进行测定[24]。向氯仿−甲醇抽提后的上清液中加入0.2倍体积的水,旋涡混合5 min后于8000 r/min下离心20 min,收集有机相,氮吹至最终体积为2 mL。之后加入2 mL 2.5 g/L K2Cr2O7溶液,沸水浴中加热45 min后自然冷却到室温。分别从每个管中取出0.25 mL放入比色管中,用水稀释至5 mL,测定350 nm波长处吸光度。使用棕榈酸标准溶液制作标准曲线,计算样品中的总脂含量(mg/(106 cells))。总碳水化合物选用苯酚−硫酸法进行测定[25]。将2 mL藻液与2 mL 5%苯酚溶液充分混合后,快速加入5 mL浓硫酸,于100 ℃水浴加热15 min,室温放置30 min后,测定485 nm处的吸光度。使用葡萄糖标准溶液替代藻液绘制标准曲线,计算总碳水化合物含量,单位为mg/(106 cells)。
1.6 数据统计与处理
结果以3个平行样测定值的平均值±标准差(SD)表示。统计分析采用SPSS 18.0进行,使用Tukey检验和Games-Howell(A)检验的单因素方差分析(ANOVA)检验处理组和对照组之间的差异,统计显著水平为P<0.05。
2 结果与讨论
2.1 TMP对2种微藻生长的影响
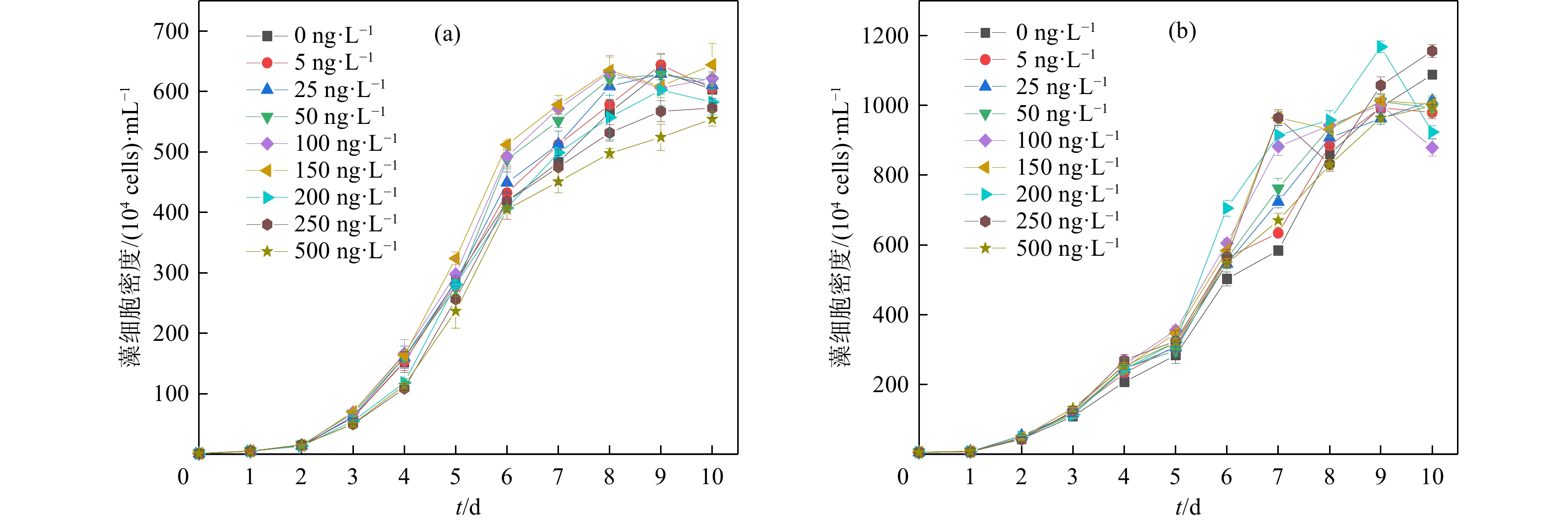
TMP对2种微藻生长的影响如图1所示。TMP对2种微藻生长的影响在暴露前3 d并不明显。随着暴露时间延长,与对照组相比,所有TMP处理组中三角褐指藻的生长在3 d后均表现出一定的促进作用,其中150 ng/L的TMP能够显著促进三角褐指藻生长(P<0.05),暴露第7 d时,150 ng/L处理组的藻细胞密度达到对照组的165%;而中肋骨条藻在TMP胁迫下表现为低浓度促进生长而高浓度抑制生长。
许多研究也证实多种淡水生物在低剂量长期暴露中存在“毒物兴奋效应”[26-27]。0.5~1 μg/L阿奇霉素能够刺激蛋白核小球藻(Chlorella pyrenoidosa)生长,而当阿奇霉素浓度大于1 μg/L时能够抑制其生长[28]。当金霉素低于0.5 mg/L时,可促进铜绿微囊藻(Microcystis aeruginosa)生长,大于1 mg/L则抑制其生长[29]。此外,抗生素对海洋生物的毒物兴奋效应也有报道。土霉素(2.5 mg/L)对1种海洋微藻——四肩突四鞭藻(Tetraselmis tetrathele)的生长具有明显促进作用[30]。然而,环境相关浓度TMP(>200 ng/L)对中肋骨条藻生长表现出抑制效应。可见目前海洋环境中存在的低浓度抗生素亦可对海洋微藻产生一定影响。需要注意的是,大环内酯类(如阿奇霉素)与四环素类(如金霉素、土霉素)等抗生素对微藻生长产生抑制效应的浓度均在μg/L级以上,明显高于TMP对海洋微藻产生抑制作用的浓度水平。
2.2 TMP对微藻光合色素的影响
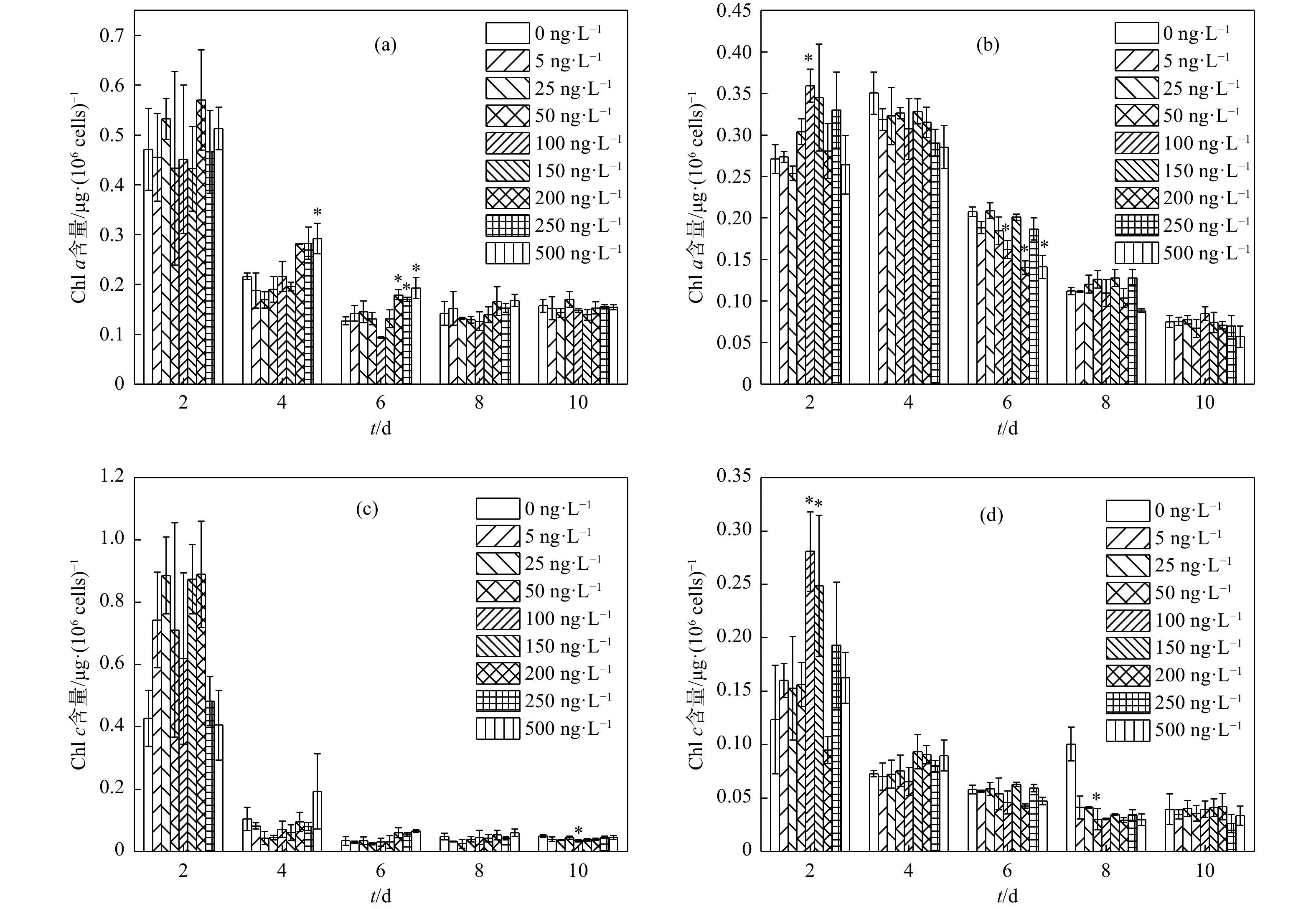
叶绿素广泛存在于高等植物和其他能进行光合作用的生物体内,其密切参与光合作用的各个阶段,包括光能吸收、能量转化和光能转换。因此,当微藻暴露于有毒化合物时,其生长变化总是与叶绿素的生物合成有关[31]。一定浓度TMP对中肋骨条藻光合色素的合成具有促进作用(图2a)。在500 ng/L TMP暴露6 d时,中肋骨条藻中Chl a的含量达到对照组的153%(P<0.05),而TMP对其Chl c含量影响较小。与前者不同,在暴露前期TMP可显著促进三角褐指藻光合色素的合成,但随着暴露时间延长,TMP可显著抑制其光合色素合成(图2b)。三角褐指藻在50 ng/L TMP中暴露2 d时,Chl a和Chl c含量均显著增加,分别比对照组增加33%和127%(P<0.05)。然而,随着暴露时间延长,暴露第6 d时,200 ng/L TMP处理组中三角褐指藻Chl a含量显著降低,仅为对照组的68%(P<0.05)。
本研究中,TMP对中肋骨条藻光合色素含量的影响低于三角褐指藻,笔者认为产生这种差异的原因主要与中肋骨条藻具有硅质细胞壁有关。Fuhrmann等[32]认为,硅藻细胞壁可能在光合作用过程中充当光子晶体片的功能。Chl a含量降低通常被认为是污染物毒性的可靠指标[33]。中肋骨条藻Chl a含量在TMP暴露期间有所升高,这与其相悖。但有研究表明,在螺旋霉素和阿莫西林的刺激下,铜绿微囊藻叶绿素水平有所提高[34]。此外,墨西哥衣藻(Chlamydomonas Mexicana)叶绿素含量随着环丙沙星浓度的增大而增加[35]。同时,微藻细胞中活性氧(ROS)积累会抑制微藻生长[36]。微藻中ROS主要产生位点为叶绿体、线粒体和过氧化物酶体三种细胞器,而叶绿素含量增加的主要作用是中和胞内积累的ROS[35]。
对三角褐指藻而言,当TMP浓度增大时,其Chl a含量显著下降(P<0.05),但其Chl c含量与对照组水平总体差别较小。由此可知,三角褐指藻的Chl c对TMP耐受性高于Chl a。综上所述,微藻光合色素对TMP的敏感性顺序为三角褐指藻>中肋骨条藻,且Chl a的敏感性大于Chl c。
2.3 TMP对微藻生化组分的影响
总蛋白、总脂和总碳水化合物是植物细胞中3类重要的活性物质,是植物良好的能量储存地,也是植物参与各种生命活动不可或缺的物质。不同浓度TMP对中肋骨条藻和三角褐指藻生物活性物质含量的影响如图3所示。蛋白质是生命活动不可缺少的物质,对植物生长过程起着至关重要的作用,常作为一项重要指标用于衡量植物的生化特征[37]。因此蛋白质含量能够反映微藻细胞生长状况。研究发现可溶性蛋白可提供代谢酶类以消除ROS[38]。TMP暴露前6 d可显著影响三角褐指藻的蛋白合成(P<0.05)。其中,500 ng/L TMP暴露2 d和4 d时,三角褐指藻的总蛋白含量分别达到对照组的235%和226%(P<0.05)(图3b)。与本研究结果相似,Wu等[39]研究发现索罗金小球藻(Chlorella sorokiniana)在土霉素初始浓度从0 mg/L提高到10 mg/L时,其蛋白质含量逐渐增加,这可能是由于微藻抵抗逆境胁迫从而积累营养物质以适应外界环境的变化[40]。TMP胁迫下中肋骨条藻总蛋白含量与对照组无显著性差异,故推断中肋骨条藻蛋白质受低水平TMP影响较小。
碳水化合物和脂质是微藻细胞良好储能物质,其中磷脂是植物细胞构成叶绿体膜、细胞膜、线粒体膜的重要成分[37]。2种微藻总碳水化合物含量在暴露前2 d均与对照组无显著性差异(P>0.05)。然而,随着暴露时间延长,TMP对2种微藻总碳水化合物的合成产生了一定的影响。暴露第4 d时,500 ng/L TMP显著促进中肋骨条藻总碳水化合物的合成(P<0.05),较对照组升高幅度为58%;而三角褐指藻总碳水化合物含量随TMP浓度升高表现出逐渐下降趋势。其中,三角褐指藻在500 ng/L TMP中暴露4 d时,其总碳水化合物含量显著低于对照组(P<0.05),降低幅度达到23%。TMP对中肋骨条藻总脂合成的影响较小(P>0.05),但可显著影响三角褐指藻总脂的合成(P<0.05)。
在TMP暴露中期,三角褐指藻总碳水化合物和总脂含量均显著降低。在不利条件下,微藻生长受阻,多余的能量可以作为碳水化合物和脂质储存[41],且由于光合作用,固碳是微藻细胞中碳水化合物的主要来源[42],因此碳水化合物含量的降低与叶绿素含量的变化趋势相似(图2b和图3d)。可溶性糖能有效捕获ROS和清除环境胁迫下藻细胞中的自由基[43]。暴露前期和后期TMP可显著促进三角褐指藻总脂合成。其中,在150 ng/L TMP下暴露2 d、10 d时,其总脂含量分别达到对照组的139%、166%(P<0.05),这与Wang等[44]和Mock等[45]的研究结果一致。磺胺嘧啶作用下蛋白核小球藻的蛋白质、碳水化合物、总脂含量均显著高于对照组[44]。此外,微藻细胞在逆境胁迫下,为维持细胞氧化还原稳态脂质含量会有所提高[45]。
3 结 论
环境相关浓度TMP对三角褐指藻的生长均表现出一定促进作用,而中肋骨条藻在TMP胁迫下呈现“毒物兴奋效应”。基于光合色素含量的结果,三角褐指藻对TMP的敏感度高于中肋骨条藻。环境浓度TMP对中肋骨条藻和三角褐指藻总蛋白、总脂和碳水化合物的合成均有一定促进作用。与三角褐指藻相比,TMP胁迫下中肋骨条藻的生化组分含量变化程度较小。总体而言,环境相关浓度TMP可对海洋微藻的生长及生化组分合成产生一定影响。然而,TMP可通过食物链进行生物富集,对高等水生生物可能存在一定的潜在危害。因此,为全面评估环境相关浓度TMP对海洋环境的影响,还需关注其对鱼类和甲壳类等海洋生物的长期影响。
-
表 1 国内外海域中TMP的污染现状
Tab. 1 The pollution status of TMP in different sea areas
国家 海域 浓度/ng·L−1 检出率/(%) 参考文献 中国 黄渤海 0.09~45.67 100 [4] 黄东海 0.269~2.88 100 [10] 莱州湾 1.3~330 100 [11] 莱州湾 5.02~398.94 100 [7] 辽东湾 1.4~18.2 100 [12] 渤海湾 ND~120 [13] 维多利亚海湾 ND~216 50 [14] 斐济 南太平洋维提岛南部 0.13~230 71 [15] 韩国 黄渤海 <0.04~1.18 100 [4] 南海 ND~5.30 83 [16] 俄罗斯 芬兰湾东部 ND~0.6 6 [17] 沙特阿拉伯 红海 ND~45.6 77 [18] 比利时 大西洋东部北海海湾 ND~29 [19] 希腊 东地中海 <0.4~3.4 100 [20] 波兰 波罗的海南部 ND~14.2 [21] 波罗的海南部 <MDL~279 100 [22] 注:ND表示未检出;MDL表示检出限 -
[1] HAN Q F, ZHAO S, ZHANG X R, et al. Distribution, combined pollution and risk assessment of antibiotics in typical marine aquaculture farms surrounding the Yellow Sea, North China[J]. Environment International, 2020, 138: 105551. doi: 10.1016/j.envint.2020.105551
[2] DU J, ZHAO H X, WANG Y, et al. Presence and environmental risk assessment of selected antibiotics in coastal water adjacent to mariculture areas in the Bohai Sea[J]. Ecotoxicology and Environmental Safety, 2019, 177: 117-123. doi: 10.1016/j.ecoenv.2019.03.075
[3] LI F F, CHEN L, CHEN W D, et al. Antibiotics in coastal water and sediments of the East China Sea: distribution, ecological risk assessment and indicators screening[J]. Marine Pollution Bulletin, 2020, 151: 110810. doi: 10.1016/j.marpolbul.2019.110810
[4] YANG L, ZHOU Y Q, SHI B, et al. Anthropogenic impacts on the contamination of pharmaceuticals and personal care products (PPCPs) in the coastal environments of the Yellow and Bohai seas[J]. Environment International, 2020, 135: 105306. doi: 10.1016/j.envint.2019.105306
[5] 王媛媛, 苏 红, 刘德举, 等. 2018-2020年全球兽用抗菌药物使用情况分析[J]. 中国动物检疫, 2022, 39(12): 72-77. [6] KOVALAKOVA P, CIZMAS L, MCDONALD T J, et al. Occurrence and toxicity of antibiotics in the aquatic environment: a review[J]. Chemosphere, 2020, 251: 126351. doi: 10.1016/j.chemosphere.2020.126351
[7] HAN Q F, SONG C, SUN X, et al. Spatiotemporal distribution, source apportionment and combined pollution of antibiotics in natural waters adjacent to mariculture areas in the Laizhou Bay, Bohai Sea[J]. Chemosphere, 2021, 279: 130381. doi: 10.1016/j.chemosphere.2021.130381
[8] DUAN W Y, SU B, FENG P F, et al. Toxicity of trimethoprim towards marine microalgae: implication for environmental risk assessment[J]. Marine and Freshwater Research, 2023, 74(13): 1145-1153. doi: 10.1071/MF23035
[9] BERGES J A, FRANKLIN D J, HARRISON P J. Evolution of an artificial seawater medium: improvements in enriched seawater, artificial water over the last two decades[J]. Journal of Phycology, 2001, 37(6): 1138-1145. doi: 10.1046/j.1529-8817.2001.01052.x
[10] 陈 贤, 张彩杰, 杨桂朋, 等. 典型药物及个人护理品在黄东海海域水体中的检测、分布规律及其风险评估[J]. 环境科学, 2020, 41(1): 194-204. [11] ZHANG R J, ZHANG G, ZHENG Q, et al. Occurrence and risks of antibiotics in the Laizhou Bay, China: impacts of river discharge[J]. Ecotoxicology and Environmental Safety, 2012, 80: 208-215. doi: 10.1016/j.ecoenv.2012.03.002
[12] JIA A, HU J Y, WU X Q, et al. Occurrence and source apportionment of sulfonamides and their metabolites in Liaodong Bay and the adjacent Liao River Basin, North China[J]. Environmental Toxicology and Chemistry, 2011, 30(6): 1252-1260. doi: 10.1002/etc.508
[13] ZOU S C, XU W H, ZHANG R J, et al. Occurrence and distribution of antibiotics in coastal water of the Bohai Bay, China: impacts of river discharge and aquaculture activities[J]. Environmental Pollution, 2011, 159(10): 2913-2920. doi: 10.1016/j.envpol.2011.04.037
[14] MINH T B, LEUNG H W, LOI I H, et al. Antibiotics in the Hong Kong metropolitan area: ubiquitous distribution and fate in Victoria Harbour[J]. Marine Pollution Bulletin, 2009, 58(7): 1052-1062. doi: 10.1016/j.marpolbul.2009.02.004
[15] DEHM J, SINGH S, FERREIRA M, et al. Screening of pharmaceuticals in coastal waters of the southern coast of Viti Levu in Fiji, South Pacific[J]. Chemosphere, 2021, 276: 130161. doi: 10.1016/j.chemosphere.2021.130161
[16] KIM H Y, LEE I S, OH J E. Human and veterinary pharmaceuticals in the marine environment including fish farms in Korea[J]. Science of the Total Environment, 2017, 579: 940-949. doi: 10.1016/j.scitotenv.2016.10.039
[17] CHERNOVA E, ZHAKOVSKAYA Z, BEREZINA N. Occurrence of pharmaceuticals in the Eastern Gulf of Finland (Russia)[J]. Environmental Science and Pollution Research, 2021, 28(48): 68871-68884. doi: 10.1007/s11356-021-15250-1
[18] ALI A M, RØNNING H T, ALARIF W, et al. Occurrence of pharmaceuticals and personal care products in effluent-dominated Saudi Arabian coastal waters of the Red Sea[J]. Chemosphere, 2017, 175: 505-513. doi: 10.1016/j.chemosphere.2017.02.095
[19] WILLE K, NOPPE H, VERHEYDEN K, et al. Validation and application of an LC-MS/MS method for the simultaneous quantification of 13 pharmaceuticals in seawater[J]. Analytical and Bioanalytical Chemistry, 2010, 397(5): 1797-1808. doi: 10.1007/s00216-010-3702-z
[20] ALYGIZAKIS N A, GAGO-FERRERO P, BOROVA V L, et al. Occurrence and spatial distribution of 158 pharmaceuticals, drugs of abuse and related metabolites in offshore seawater[J]. Science of the Total Environment, 2016, 541: 1097-1105. doi: 10.1016/j.scitotenv.2015.09.145
[21] BORECKA M, SIEDLEWICZ G, HALIŃSKI Ł P, et al. Contamination of the southern Baltic Sea waters by the residues of selected pharmaceuticals: method development and field studies[J]. Marine Pollution Bulletin, 2015, 94(1/2): 62-71.
[22] SIEDLEWICZ G, BIAŁK-BIELIŃSKA A, BORECKA M, et al. Presence, concentrations and risk assessment of selected antibiotic residues in sediments and near-bottom waters collected from the polish coastal zone in the southern Baltic Sea—summary of 3 years of studies[J]. Marine Pollution Bulletin, 2018, 129(2): 787-801. doi: 10.1016/j.marpolbul.2017.10.075
[23] JEFFREY S W, HUMPHREY G F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton[J]. Biochemie und Physiologie der Pflanzen, 1975, 167(2): 191-194. doi: 10.1016/S0015-3796(17)30778-3
[24] PANDE S V, KHAN R P, VENKITASUBRAMANIAN T A. Microdetermination of lipids and serum total fatty acids[J]. Analytical Biochemistry, 1963, 6(5): 415-423. doi: 10.1016/0003-2697(63)90094-0
[25] LIU D, WONG P T S, DUTKA B J. Determination of carbohydrate in lake sediment by a modified phenol-sulfuric acid method[J]. Water Research, 1973, 7(5): 741-746. doi: 10.1016/0043-1354(73)90090-0
[26] SUN H Y, PAN Y Z, CHEN X, et al. Regular time-dependent cross-phenomena induced by hormesis: a case study of binary antibacterial mixtures to Aliivibrio fischeri[J]. Ecotoxicology and Environmental Safety, 2020, 187: 109823. doi: 10.1016/j.ecoenv.2019.109823
[27] MO L Y, LIU Y A, ZHU J, et al. Benefits from hazards, benefits from nothing, and benefits from benefits: the combined effects of five Quaternary ammonium compounds to Vibrio qinghaiensis Q67[J]. Environmental Sciences Europe, 2020, 32(1): 35. doi: 10.1186/s12302-020-00310-z
[28] MAO Y F, YU Y, MA Z X, et al. Azithromycin induces dual effects on microalgae: roles of photosynthetic damage and oxidative stress[J]. Ecotoxicology and Environmental Safety, 2021, 222: 112496. doi: 10.1016/j.ecoenv.2021.112496
[29] GUO R X, CHEN J Q. Phytoplankton toxicity of the antibiotic chlortetracycline and its UV light degradation products[J]. Chemosphere, 2012, 87(11): 1254-1259. doi: 10.1016/j.chemosphere.2012.01.031
[30] SEOANE M, RIOBOO C, HERRERO C, et al. Toxicity induced by three antibiotics commonly used in aquaculture on the marine microalga Tetraselmis suecica (Kylin) Butch[J]. Marine Environmental Research, 2014, 101: 1-7. doi: 10.1016/j.marenvres.2014.07.011
[31] XIONG J Q, KURADE M B, ABOU-SHANAB R A I, et al. Biodegradation of carbamazepine using freshwater microalgae Chlamydomonas mexicana and Scenedesmus obliquus and the determination of its metabolic fate[J]. Bioresource Technology, 2016, 205: 183-190. doi: 10.1016/j.biortech.2016.01.038
[32] FUHRMANN T, LANDWEHR S, EL RHARBI-KUCKI M, et al. Diatoms as living photonic crystals[J]. Applied Physics B, 2004, 78(3/4): 257-260.
[33] NIE X P, WANG X, CHEN J F, et al. Response of the freshwater alga Chlorella vulgaris to trichloroisocyanuric acid and ciprofloxacin[J]. Environmental Toxicology and Chemistry, 2008, 27(1): 168-173. doi: 10.1897/07-028.1
[34] LIU Y, ZHANG J, GAO B Y, et al. Combined effects of two antibiotic contaminants on Microcystis aeruginosa[J]. Journal of Hazardous Materials, 2014, 279: 148-155. doi: 10.1016/j.jhazmat.2014.07.002
[35] XIONG J Q, KURADE M B, KIM J R, et al. Ciprofloxacin toxicity and its co-metabolic removal by a freshwater microalga Chlamydomonas mexicana[J]. Journal of Hazardous Materials, 2017, 323: 212-219. doi: 10.1016/j.jhazmat.2016.04.073
[36] 刘 璇, 张 莹, 李爱芬. 活性氧介导微藻脂质积累的研究现状及进展[J]. 植物生理学报, 2022, 58(7): 1201-1211. [37] 查荣博, 张 辉, 孙佳明. 微藻的有效成分及生物活性[J]. 吉林中医药, 2015, 35(1): 64-67. [38] 张 丽, 蒋凤华, 曹 为, 等. 四溴双酚A(TBBPA)对中肋骨条藻的毒性效应研究[J]. 生态毒理学报, 2014, 9(6): 1219-1225. [39] WU S, ZHANG J M, XIA A, et al. Microalgae cultivation for antibiotic oxytetracycline wastewater treatment[J]. Environmental Research, 2022, 214: 113850. doi: 10.1016/j.envres.2022.113850
[40] BRANCO D, LIMA A, ALMEIDA S F P, et al. Sensitivity of biochemical markers to evaluate cadmium stress in the freshwater diatom Nitzschia palea (Kützing) W. Smith[J]. Aquatic Toxicology, 2010, 99(2): 109-117. doi: 10.1016/j.aquatox.2010.04.010
[41] GEORGE B, PANCHA I, DESAI C, et al. Effects of different media composition, light intensity and photoperiod on morphology and physiology of freshwater microalgae Ankistrodesmus falcatus – a potential strain for bio-fuel production[J]. Bioresource Technology, 2014, 171: 367-374. doi: 10.1016/j.biortech.2014.08.086
[42] XIONG J Q, GOVINDWAR S, KURADE M B, et al. Toxicity of sulfamethazine and sulfamethoxazole and their removal by a green microalga, Scenedesmus obliquus[J]. Chemosphere, 2019, 218: 551-558. doi: 10.1016/j.chemosphere.2018.11.146
[43] MOHAMED Z A. Polysaccharides as a protective response against microcystin-induced oxidative stress in Chlorella vulgaris and Scenedesmus quadricauda and their possible significance in the aquatic ecosystem[J]. Ecotoxicology, 2008, 17(6): 504-516. doi: 10.1007/s10646-008-0204-2
[44] WANG H T, HU C Y, WANG Y, et al. Elucidating microalgae-mediated metabolism for sulfadiazine removal mechanism and transformation pathways[J]. Environmental Pollution, 2023, 327: 121598. doi: 10.1016/j.envpol.2023.121598
[45] MOCK T, KROON B M A. Photosynthetic energy conversion under extreme conditions—I: important role of lipids as structural modulators and energy sink under N-limited growth in Antarctic sea ice diatoms[J]. Phytochemistry, 2002, 61(1): 41-51. doi: 10.1016/S0031-9422(02)00216-9




 下载:
下载: